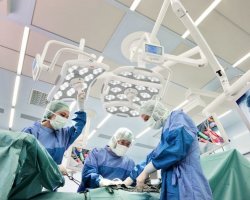
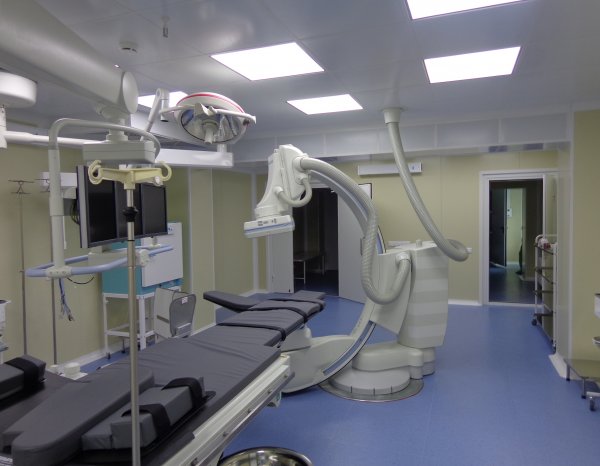
Группа компаний "Реал Инжиниринг" специализируется на проектировании, строительстве, реконструкции и модернизации производств для фармацевтической, биотехнологической, микро- и радиоэлектронной, парфюмерно-косметической и пищевой промышленности, а также научно-исследовательских лабораторий и медицинских учреждений.
Технологии чистых и специальных помещений для промышленности, науки и медицины - наша профессиональная компетенция.
Чистые помещения для:

Наши компетенции
Наши конкурентные преимущества
Собственная система конструкций
Собственная система конструкций специальных и чистых помещений "Реал Клинрум"
Группа компаний "Реал инжиниринг" является разработчиком и производителем системы ограждающих конструкций чистых помещений "Реал Клинрум"®. Система ограждающих конструкций “Реал Клинрум”® - это конструкции типа «КОМНАТА В КОМНАТЕ», формирующие изолирующий контур, в котором контролируются необходимые параметры: чистота воздуха, температура, перепад давления и пр. Система состоит из: -Перегородки и облицовочные панели -Двери, окна, передаточные камеры -Герметичный потолок -Специальные профили подробнее Система ограждающих конструкций “Реал Клинрум”®
100 +
реализованных проектов
20 лет
опыт сотрудников
30 +
регионов работы (РФ, ЕАЭС)
2
года гарантии

Более 20 лет опыта наших специалистов.
Более 100 построенных и сданных объектов чистых и специальных помещений для различных отраслей с классами чистоты от ИСО 9 до до ИСО 3.

Мы работаем в любых регионах.
Нам не важно в каком городе находится ваш объект, мы работаем по всей России и в странах ЕАЭС.

Берём любые объёмы.
Мы работаем как с небольшими объемами, так реализуем и крупные проекты.

Собственные монтажные подразделения.
Группа компаний имеет собственные монтажные подразделения, обеспечивающие выполнение основных видов работ своими силами.

Полный комплекс работ.
Мы готовы взять на себя полный комплекс работ (все разделы проекта) по проектированию и строительству чистых и специальных помещений на любом объекте до ввода в эксплуатацию, включая аттестацию чистых помещений.

Мы минимизируем ваши риски.
Мы предоставляем гарантию 2 года на свои работы, наши объекты эксплуатируются уже более 15 лет. Мы постоянно на связи.

Собственная система конструкций чистых помещений "Реал-Клинрум"
ГК "Реал-инжиниринг" является разработчиком и производителем системы ограждающих конструкций чистых помещений "Реал Клинрум" (панели, потолок, окна, двери, специальные профили).
Чистые помещения для промышленности, науки и медицины.
Мы всегда готовы оказать Вам необходимую консультацию:
+7 (831) 295 91 19
Получить опросный лист для ТЗ
Получить коммерческое предложение
Направить ТЗ
Наш подход к строительству чистых помещений
Индивидуальный подход к каждому заказчику - один из принципов работы ГК "Реал инжиниринг". Каждый проект в сфере специальных и чистых помещений уникален и требует индивидуальной разработки, в каждом конкретном случае могут быть предложены различные варианты как по архитектурно-строительному решению и инженерным системам, так и по спецификациям материалов и оборудования, методике исполнения.
1.Переговоры с Заказчиком
Переговоры с Заказчиком и определение его потребностей и планов, согласование принципиальных объемов (границ) проекта.
2.Выезд специалистов
Выезд специалистов на объект, сбор информации и исходных данных, заполнение опросных листов.
3.Составление техзадания
Составление и получение Технического задания от Заказчика.
4.Определение параметров объекта
Определение параметров объекта (участка) и постановка задач для предварительной оценки инженерных систем.
5.Предварительная оценка
Составление предварительной оценки по всем видам работ и оборудования (с точностью до 10-15 %).
6.Утверждение задания
Составление согласованного задания на проектирование и формирование пакета исходных данных.
7.Оформление договора
Оформление Договора на разработку рабочей документации, сметы, плана-графика проектных работ.
8.Разработка проекта
Разработка проекта, базового проектного решения (стадия П, РП).
9.Предоставление проекта
Предоставление проекта на рассмотрение Заказчику, внесение уточнений, согласования.
10.Разработка документации
Разработка рабочей документации (РД).
11.Утверждение проекта
Утверждение и принятие проекта заказчиком, экспертиза проекта в надзорных органах, аттестация проекта (DQ).
12.Разработка сметы
Разработка сметы (уточненной калькуляции) на основе рабочей документации.
13.Оформление договора подряда
На поставки конструктивных элементов и материалов чистых помещений, оборудования и материалов инженерных систем, и на монтажные и пусконаладочные работы
14.Авансирование работ
Авансирование работ (закупка материалов и оборудования).
15.Выезд специалиста на объект
Повторный выезд специалиста на объект для подтверждения наличия строительной готовности.
16.Доставка материалов
Доставка материалов и оборудования на объект. Как правило, несколькими заранее оговоренными этапами.
17.Монтаж инженерных систем
По отдельной договоренности, монтаж выполняется в несколько этапов, по мере строительной готовности.
18.Монтаж конструктивных элементов
Монтаж конструктивных элементов чистых помещений.
19.Обеспечение интеграции
Обеспечение интеграции конструктивных элементов чистых помещений и инженерных систем.
20.Авторский надзор проектировщика
Возникающие в процессе монтажа изменения и уточнения проекта, должны быть утверждены и согласованы обеими сторонами, и только после этого возможно продолжение монтажа.
21.Финишные работы
Финишные монтажно-инсталляционные работы. Окончание монтажа, внутренняя приёмка. Уборка объекта.
22.Сдача объекта заказчику
Сдача объекта заказчику в состоянии монтажной готовности.
23.Пусконаладочные работы.
Пусконаладочные работы. Валидация, аттестация чистых помещений.
24.Подписание актов
Подписание актов сдачи-приемки работ и оплата оставшейся стоимости работ в соответствии с условиями договора.
Мы реализовали множество проектов чистых помещений, вот некоторые из них:
Система конструкций чистых помещений
Группа компаний "Реал инжиниринг" проектирует, производит и монтирует комплексы специальных и чистых помещений (КСЧП), основным элементом которых являются ограждающие конструкции чистых помещений системы "Реал Клинрум", включающие: панели для перегородок и облицовки, потолок чистых помещений, специальные окна и двери, скругляющие профили и другие элементы.